Giá: 0
ĐẶT HÀNG
(Nhận hàng trả tiền, không thích không mua)
(Nhận hàng trả tiền, không thích không mua)
Gọi đặt mua ngay: 0912.514.338 (Tư vấn miễn phí)
ĐỊA CHỈ MUA HÀNG
Cơ sở 1: 125 Chùa Bộc - Đống Đa - Hà Nội.
Cơ sở 2: 103 Trịnh Công Sơn - Tây Hồ - Hà Nội.
Cơ sở 3: 9A tổ 24C Thanh Lương - Hai Bà Trưng - Hà Nội.
Cơ sở 4: 87 ngõ 34 Phố Vĩnh Tuy - Hai Bà Trưng - Hà Nội.
Cơ sở 5: 23 Ngõ 622 Minh Khai – Hà Nội.
Cơ sở 6: Ngọc Chi – Vĩnh Ngọc – Đông Anh – Hà Nội
Cơ sở 7: Thôn Đông – Việt Hùng – Đông Anh – Hà Nội
Cơ sở 8: Chợ Bắc Hồng - Đông Anh - Hà Nội
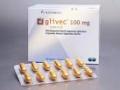
THÔNG TIN SẢN PHẨM
Dạng thuốc
Hộp 6 vỉ x 10 viên
Thành phần, hàm lượng
Imatinib: 100mg
Chỉ định(Dùng cho trường hợp)
Điều trị bệnh nhân người lớn và trẻ em bị bệnh bạch cầu tủy mạn (CML) mới được chẩn đoán.
Điều trị bệnh nhân người lớn và trẻ em bị bệnh bạch cầu tủy mạn trong cơn nguyên bào, giai đoạn cấp tính hoặc giai đoạn mạn tính sau khi đã thất bại với điều trị interferon-alpha.
Điều trị bệnh nhân người lớn bị bệnh bạch cầu nguyên bào lymphô cấp với nhiễm sắc thể Philadelphia dương tính (Ph+ ALL) được sử dụng hóa liệu pháp.
Điều trị bệnh nhân người lớn bị bệnh bạch cầu nguyên bào lymphô cấp với nhiễm sắc thể Philadelphia dương tính tái phát hoặc kháng lại khi dùng đơn trị liệu.
Điều trị bệnh nhân người lớn bị bệnh loạn sản tủy/tăng sinh tủy xương (MDS/MPD) có liên quan tới sự sắp xếp lại gen của thụ thể yếu tố tăng trưởng có nguồn gốc tiểu cầu (PDGFR).
Điều trị bệnh nhân người lớn bị bệnh lý dưỡng bào hệ thống (SM) không có đột biến D816V c-Kit hoặc chưa biết tình trạng đột biến c-Kit.
Điều trị bệnh nhân người lớn bị hội chứng tăng bạch cầu ái toan (HES) và/hoặc bệnh bạch cầu mạn tế bào ái toan(CEL).
Điều trị bệnh nhân người lớn bị u mô đệm dạ dày ruột (GIST) ác tính không thể cắt bỏ và/hoặc đã di căn.
Điều trị bổ trợ cho bệnh người lớn sau phẫu thuật cắt bỏ GIST.
Điều trị bệnh nhân người lớn bị u sarcom xơ da (DFSP) không thể cắt bỏ, tái phát và/hoặc đã di căn.
Hiệu quả của Glivec dựa trên tỷ lệ đáp ứng chung về huyết học và di truyền học tế bào và số bệnh nhân sống sót không có tiến triển trong nhóm CML, tỷ lệ đáp ứng về huyết học và di truyền học tế bào trong nhóm Ph+ ALL, MDS/MPD, tỉ lệ đáp ứng về huyết học trong nhóm SM, HES/CEL, về tỷ lệ đáp ứng với mục tiêu và số bệnh nhân sống sót không có tiến triển trong nhóm GIST không thể cắt bỏ và/hoặc đã di căn, về số bệnh nhân sống sót không có tái phát trong nhóm điều trị bổ trợ GIST, và tỷ lệ đáp ứng với mục tiêu trong nhóm DFSP. Từ các thử nghiệm có kiểm chứng cho thấy tỉ lệ sống sót tăng chỉ ở nhóm CML giai đoạn mạn tính mới được chẩn đoán và GIST.
Liều dùng
Chống chỉ định(Không dùng cho những trường hợp sau)
Quá mẫn với thành phần thuốc.
Liều dùng
Việc điều trị nên được bắt đầu bởi một bác sĩ có kinh nghiệm trong việc điều trị bệnh nhân bị các u ác tính về huyết học và các sarcom ác tính, khi thích hợp.
Nên uống liều được kê đơn cùng với bữa ăn và một ly nhiều nước. Liều 400 mg hoặc 600 mg nên dùng một lần/ngày trong khi liều 800 mg/ngày nên dùng dưới dạng 400 mg, 2 lần/ngày, vào buổi sáng và buổi tối.
Đối với những bệnh nhân không thể nuốt viên nén bao phim, có thể hòa viên nén vào một ly nước hoặc nước táo. Số viên cần dùng nên được cho vào một lượng thức uống thích hợp (khoảng 50 mL cho 1 viên 100 mg và 200 mL cho 1 viên 400 mg) và khuấy bằng muỗng. Hỗn dịch phải được dùng ngay sau khi viên nén đã tan rã hoàn toàn.
Liều dùng đối với bệnh bạch cầu tủy mạn (CML)
Liều Glivec khuyến cáo là 400 mg/ngày đối với bệnh nhân bị bệnh CML giai đoạn mạn tính và 600 mg/ngày đối với bệnh nhân trong giai đoạn cấp tính hoặc cơn nguyên bào.
Cần tiếp tục điều trị chừng nào vẫn còn có lợi cho bệnh nhân.
Có thể xem xét tăng liều từ 400 mg đến 600 mg hoặc 800 mg ở bệnh nhận bị bệnh giai đoạn mạn tính, hoặc từ 600 mg đến tối đa 800 mg/ngày ở bệnh nhân trong giai đoạn cấp tính hoặc cơn nguyên bào khi không có phản ứng phụ nặng và giảm bạch cầu trung tính hoặc giảm tiểu cầu nặng không liên quan đến bệnh bạch cầu trong những tình trạng sau đây: tiến triển bệnh (ở bất kỳ thời điểm nào), không đạt được đáp ứng huyết học thỏa đáng sau ít nhất 3 tháng điều trị, không đạt được đáp ứng di truyền học tế bào sau 12 tháng điều trị, hoặc mất đáp ứng về huyết học và/hoặc di truyền học tế bào đã đạt được trước đây.
Liều dùng cho trẻ em nên dựa trên diện tích bề mặt cơ thể (mg/m2). Liều 340 mg/m2/ngày được khuyến cáo cho trẻ em bị bệnh bạch cầu tủy mạn giai đoạn mạn tính và giai đoạn tiến triển (không được vượt quá tổng liều 600 mg/ngày). Có thể điều trị một liều 1 lần/ngày hoặc một cách khác là liều hàng ngày có thể chia làm 2 lần dùng - một lần vào buổi sáng và một lần vào buổi tối. Liều dùng khuyến cáo hiện nay được dựa trên một số lượng nhỏ bệnh nhi. Chưa có kinh nghiệm về việc dùng Glivec cho trẻ em dưới 2 tuổi.
Liều dùng đối với bệnh bạch cầu nguyên bào lymphô cấp với nhiễm sắc thể Philadelphia dương tính(Ph+ ALL)
Liều Glivec khuyến cáo là 600 mg/ngày cho bệnh nhân bị Ph+ ALL.
Liều dùng đối với bệnh loạn sản tủy/tăng sinh tủy xương(MDS/MPD)
Liều Glivec khuyến cáo là 400 mg/ngày cho bệnh nhân bị MDS/MPD
Liều dùng đối với bệnh lý dưỡng bào hệ thống (SM)
Liều Glivec khuyến cáo là 400 mg/ngày cho bệnh nhân bị SM không có đột biến D816V c-Kit. Nếu tình trạng đột biến c-Kit chưa được biết đến hoặc không có sẵn, điều trị Glivec với liều 400 mg/ngày có thể được xem xét cho bệnh nhân bị SM không đáp ứng đầy đủ với các trị liệu khác.
Đối với bệnh nhân bị SM kết hợp với tăng bạch cầu ưa eosin, một bệnh huyết học dòng vô tính có liên quan đến fusion kinase FIP1L1-PDGFR-alpha, liều khởi đầu 100 mg/ngày được khuyến cáo. Việc tăng liều từ 100 mg lên 400 mg cho những bệnh nhân này có thể được xem xét khi không bị các tác dụng phụ của thuốc, nếu việc đánh giá cho thấy rằng đáp ứng với điều trị là chưa đầy đủ.
Liều dùng đối với hội chứng tăng bạch cầu ái toan và/hoặc bệnh bạch cầu mạn tế bào ái toan (HES/CEL)
Liều Glivec khuyến cáo là 400 mg/ngày cho bệnh nhân bị HES/CEL.
Đối với bệnh nhân bị HES/CEL với FIP1L1-PDGFR-alpha fusion kinase đã được chứng minh, liều khởi đầu 100 mg/ngày được khuyến cáo. Việc tăng liều từ 100 mg lên 400 mg cho những bệnh nhân này có thể được xem xét khi không bị các tác dụng phụ của thuốc, nếu việc đánh giá cho thấy rằng đáp ứng với điều trị là chưa đầy đủ.
Cần tiếp tục điều trị chừng nào vẫn còn có lợi cho bệnh nhân.
Liều dùng đối với bệnh u mô đệm dạ dày ruột (GIST)
Liều Glivec khuyến cáo là 400 mg/ngày cho bệnh nhân bị GIST ác tính không thể cắt bỏ và/hoặc đã di căn.
Có thể xem xét tăng liều từ 400 mg đến 600 mg hoặc 800 mg cho bệnh nhân khi không có các phản ứng phụ nếu đánh giá thấy đáp ứng điều trị không đầy đủ.
Việc điều trị Glivec cho bệnh nhân bị GIST nên tiếp tục khi bệnh vẫn tiến triển.
Liều Glivec khuyến cáo là 400 mg/ngày để điều trị bổ trợ cho bệnh người lớn sau phẫu thuật cắt bỏ GIST. Thời gian điều trị tối ưu với Glivec cho điều trị bổ trợ chưa được biết đến.
Liều dùng đối với bệnh u sarcom xơ da (DFSP)
Liều Glivec khuyến cáo là 800 mg/ngày cho bệnh nhân bị DFSP.
Điều chỉnh liều đối với các phản ứng phụ
Phản ứng phụ không thuộc huyết học
Nếu có một phản ứng phụ nặng không thuộc huyết học xảy ra khi dùng Glivec, phải ngừng điều trị cho đến khi trường hợp này được giải quyết. Sau đó có thể điều trị trở lại khi thích hợp tùy thuộc vào độ nặng ban đầu của phản ứng phụ đó.
Nếu nồng độ bilirubin tăng > 3 x giới hạn trên của mức bình thường (IULN) hoặc transaminase gan tăng > 5 x IULN, phải ngừng Glivec cho đến khi nồng độ bilirubin trở về < 1,5 x IULN và nồng độ transaminase trở về < 2,5 x IULN. Sau đó có thể tiếp tục điều trị Glivec với liều hàng ngày đã được giảm. Ở người lớn, nên giảm liều từ 400 mg xuống 300 mg, hoặc từ 600 mg xuống 400 mg, hoặc từ 800 mg xuống 600 mg, và trẻ em từ 340 mg/m2/ngày xuống 260 mg/m2/ngày.
Phản ứng phụ về huyết học
Khuyến cáo giảm liều hoặc ngừng điều trị đối với giảm bạch cầu trung tính và giảm tiểu cầu nặng được biểu thị trong bảng dưới đây.
Trẻ em
Chưa có kinh nghiệm về việc sử dụng Glivec cho trẻ em dưới 2 tuổi bị bệnh bạch cầu tủy mạn. Chỉ có rất ít kinh nghiệm về việc sử dụng Glivec cho trẻ em dưới 3 tuổi ở các chỉ định khác.
Suy gan
Imatinib được chuyển hóa chủ yếu qua gan. Bệnh nhân bị rối loạn chức năng gan nhẹ, trung bình hoặc nặng nên dùng liều thấp nhất được khuyến cáo là 400 mg/ngày. Liều này có thể giảm xuống nếu không được dung nạp.
Suy thận
Imatinib và các chất chuyển hóa của nó không được bài tiết đáng kể qua thận. Do hệ số thanh thải thận của imatinib không đáng kể, sự giảm hệ số thanh thải thuốc ở dạng tự do không thể xảy ra trên bệnh nhân bị suy thận. Những bệnh nhân bị rối loạn chức năng thận nhẹ hoặc trung bình nên dùng liều khởi đầu thấp nhất được khuyến cáo là 400 mg/ngày. Mặc dù thông tin còn rất hạn chế, những bệnh nhân bị rối loạn chức năng thận nặng hoặc đang thẩm phân máu cũng có thể khởi đầu với liều tương tự là 400 mg. Tuy nhiên, khuyến cáo thận trọng đối với những bệnh nhân này. Liều này có thể giảm xuống nếu không được dung nạp, hoặc tăng lên nếu thiếu hiệu quả.
Bệnh nhân cao tuổi
Không quan sát thấy sự khác biệt đáng kể về dược động học liên quan đến tuổi ở bệnh nhân người lớn trong các thử nghiệm lâm sàng bao gồm trên 20% bệnh nhân từ 65 tuổi trở lên. Không cần liều khuyến cáo đặc biệt cho bệnh nhân cao tuổi.
Nên dùng Glivec cùng với thức ăn và một ly nhiều nước để làm giảm thiểu nguy cơ rối loạn tiêu hóa. Khi dùng phối hợp Glivec với các thuốc khác, có khả năng xảy ra tương tác thuốc.
Một bệnh nhân khi sốt thường dùng paracetamol/acetaminophen đã chết vì suy gan cấp. Mặc dù hiện nay nguyên nhân gây tử vong vẫn chưa rõ, phải thận trọng đặc biệt khi dùng paracetamol/acetaminophen.
Đã có báo cáo về các trường hợp suy giáp trên lâm sàng ở bệnh nhân cắt tuyến giáp đang dùng levothyroxine thay thế trong khi điều trị bằng Glivec. Cần theo dõi chặt chẽ nồng độ TSH ở những bệnh nhân này.
Ở bệnh nhân bị rối loạn chức năng gan (nhẹ, trung bình hoặc nặng), phải theo dõi chặt chẽ công thức máu ngoại vi và các enzyme gan.
Khi imatinib được kết hợp với hóa liệu pháp liều cao, đã quan sát thấy độc tính gan thoáng qua dưới dạng tăng transaminase và tăng bilirubin máu. Khuyến cáo theo dõi chức năng gan trong trường hợp imatinib được kết hợp với hóa liệu pháp đã biết là có liên quan với rối loạn chức năng gan.
Đã có báo cáo về ứ dịch nặng (tràn dịch màng phổi, phù, phù phổi, cổ trướng, phù bề mặt) trong khoảng 2,5% bệnh nhân bị bệnh bạch cầu tủy mạn mới được chẩn đoán đang dùng Glivec. Vì vậy, bệnh nhân nên cân thường xuyên. Phải kiểm tra cẩn thận hiện tượng tăng cân nhanh bất thường và nếu cần nên tiến hành các biện pháp chăm sóc hỗ trợ và điều trị thích hợp. Trong các thử nghiệm lâm sàng, tỷ lệ các trường hợp này tăng lên ở bệnh nhân cao tuổi và những người có tiền sử về bệnh tim.
Bệnh nhân bị bệnh tim hoặc có các yếu tố nguy cơ gây suy tim phải được kiểm soát chặt chẽ và bất cứ bệnh nhân nào có dấu hiệu hoặc triệu chứng phù hợp với suy tim phải được đánh giá và điều trị.
Ở những bệnh nhân bị hội chứng tăng tính ưa eosin (HES) có ảnh hưởng đến tim, các trường hợp riêng lẻ bị sốc do tim/rối loạn chức năng thất trái có liên quan đến việc khởi đầu điều trị bằng imatinib. Tình trạng này được báo cáo là phục hồi với điều trị bằng steroid toàn thân, các biện pháp hỗ trợ tuần hoàn và ngừng imatinib tạm thời. Bệnh loạn sản tủy/tăng sinh tủy xương và u dưỡng bào hệ thống có thể kết hợp với các mức bạch cầu ưa eosin cao. Do đó làm siêu âm tim đồ và xác định troponin huyết thanh phải được xem xét ở những bệnh nhân bị HES/CEL, và những bệnh nhân bị MDS/MPD hoặc SM kết hợp với các mức bạch cầu ưa eosin cao. Nếu có bất thường, dự phòng bằng steroid toàn thân (1 - 2 mg/kg) trong 1 - 2 tuần kết hợp với imatinib phải được xem xét khi bắt đầu điều trị.
Xét nghiệm
Phải tiến hành làm công thức máu toàn phần thường xuyên trong thời gian điều trị bằng Glivec. Việc điều trị bệnh nhân bị bệnh bạch cầu tủy mạn bằng Glivec có liên quan với giảm bạch cầu trung tính hoặc giảm tiểu cầu. Tuy nhiên, sự giảm tế bào máu này phụ thuộc vào giai đoạn bệnh được điều trị và thường gặp hơn ở những bệnh nhân bị bệnh bạch cầu tủy mạn giai đoạn cấp tính hoặc cơn nguyên bào so với những bệnh nhân bị bệnh bạch cầu tủy mạn giai đoạn mạn tính. Có thể ngừng điều trị bằng Glivec hoặc giảm liều như đã khuyến cáo trong phần liều lượng và cách dùng.
Phải theo dõi chức năng gan đều đặn (transaminase, bilirubin, phosphatase kiềm) ở bệnh nhân đang dùng Glivec. Như đã khuyến cáo trong phần Liều lượng và cách dùng, phần Phản ứng phụ không thuộc huyết học, những bất thường về xét nghiệm này phải được xử trí bằng cách ngừng dùng và/hoặc giảm liều điều trị Glivec.
Glivec và các chất chuyển hóa của nó không được bài tiết qua thận ở một mức độ đáng kể. Hệ số thanh thải Creatinine (CrCL) được biết là giảm theo tuổi, nhưng tuổi không ảnh hưởng đáng kể đến động học của Glivec. Ở bệnh nhân bị suy chức năng thận, sự tồn lưu imatinib trong huyết tương dường như cao hơn so với bệnh nhân có chức năng thận bình thường, có lẽ là do nồng độ alpha-acid glycoprotein (AGP) trong huyết tương - là một protein gắn với imatinib, tăng lên ở những bệnh nhân này. Không có sự liên quan giữa sự tồn lưu imatinib và mức độ suy thận như đã được phân biệt bằng cách đo hệ số thanh thải creatinine (CrCL), giữa các bệnh nhân bị suy thận nhẹ (CrCL: 40-59 ml/phút) và nặng (CrCL: < 20 ml/phút). Tuy nhiên, như đã khuyến cáo trong phần Liều lượng và cách dùng, có thể giảm liều imatinib khởi đầu nếu không được dung nạp.
Tác động trên khả năng lái xe và sử dụng máy móc:
Trong khi chưa có báo cáo cụ thể nào, nên khuyên bệnh nhân là họ có thể gặp các tác dụng không mong muốn như chóng mặt hoặc nhìn mờ trong khi điều trị bằng Glivec. Vì vậy khuyến cáo nên thận trọng khi lái xe hoặc vận hành máy móc.
Nhà sản xuất
Novartis AG.
Mô tả sản phẩm
SẢN PHẨM CÙNG LOẠI KHÁC
[ Quay lại ] [ Lên đầu trang ]