Cơ sở 1: 125 Chùa Bộc - Đống Đa - Hà Nội.
Cơ sở 2: 103 Trịnh Công Sơn - Tây Hồ - Hà Nội.
Cơ sở 3: 9A tổ 24C Thanh Lương - Hai Bà Trưng - Hà Nội.
Cơ sở 4: 87 ngõ 34 Phố Vĩnh Tuy - Hai Bà Trưng - Hà Nội.
Cơ sở 5: 23 Ngõ 622 Minh Khai – Hà Nội.
Cơ sở 6: Ngọc Chi – Vĩnh Ngọc – Đông Anh – Hà Nội
Cơ sở 7: Thôn Đông – Việt Hùng – Đông Anh – Hà Nội
Cơ sở 8: Chợ Bắc Hồng - Đông Anh - Hà Nội
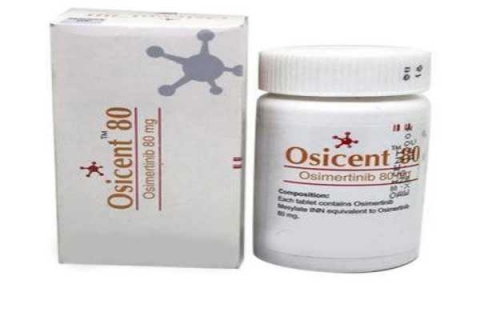
Osicent 80mg
Thuốc Osicent 80mg (thuốc Osimertinib) được sử dụng để điều trị ung thư phổi không phải tế bào nhỏ ở giai đoạn tiên tiến hoặc di căn (NSCLC), khi ung thư có đột biến T790M cụ thể trong gen mã hoá cho thụ thể nhân tố tăng trưởng biểu bì. Ở Hoa Kỳ, đột biến phải được phát hiện bằng xét nghiệm chẩn đoán đồng hành được FDA chấp thuận và người đó phải ngừng đáp ứng với các chất ức chế EGFR khác.
Thuốc Osicent 80mg thuốc Osimertinib mua ở đâu giá bao nhiêu?
-
Thuốc Osicent 80mg (thuốc Osimertinib) được sử dụng để điều trị ung thư phổi không phải tế bào nhỏ ở giai đoạn tiên tiến hoặc di căn (NSCLC), khi ung thư có đột biến T790M cụ thể trong gen mã hoá cho thụ thể nhân tố tăng trưởng biểu bì. Ở Hoa Kỳ, đột biến phải được phát hiện bằng xét nghiệm chẩn đoán đồng hành được FDA chấp thuận và người đó phải ngừng đáp ứng với các chất ức chế EGFR khác.
NSCLC ở những người tiếp nhận thuốc đã phát triển các đột biến kháng thuốc, cụ thể là C797S xảy ra trong EGFR exon 20 hoặc khuếch đại gen EGFR, ngay cả khi các dòng vô tính T790M đã được loại bỏ.
Nó gây hại cho thai nhi, vì vậy không nên dùng ở phụ nữ đang mang thai và những phụ nữ dùng nó nên tránh mang thai
Cần lưu ý ở những người có tiền sử bệnh phổi kẽ (interdstial lung disease - ILD) đã được loại trừ khỏi các thử nghiệm lâm sàng vì thuốc có thể gây ILD hoặc viêm phổi nặng. Cũng nên thận trọng khi dùng cho người có tiền sử mắc hội chứng QT vì thuốc có thể gây ra chứng này.Tác dụng ngoại ý khi dùng thuốc Osicent 80mg (hoạt chất Osimertinib)
Rất phổ biến (trên 10% các thử nghiệm lâm sàng) các tác dụng phụ bao gồm tiêu chảy, viêm dạ dày, phát ban, da khô hoặc ngứa, nhiễm trùng ở ngón tay hoặc móng chân ở da, số lượng tiểu cầu thấp, số bạch cầu thấp và số lượng bạch cầu trung tính thấp
Phổ biến (từ 1% đến 10% đối tượng thử nghiệm lâm sàng) tác dụng phụ bao gồm bệnh phổi kẽ.Tương tác thuốc khi dùng thuốc Osicent 80mg
Thuốc Osimertinib được chuyển hóa bởi CYP3A4 và CYP3A5, do đó các chất ức chế mạnh enyzme, như kháng sinh macrolide, thuốc chống nấm và thuốc chống siêu vi khuẩn có thể làm tăng tiếp xúc với osimertinib, và các chất như rifampicin kích hoạt một trong hai enzym sẽ làm giảm hiệu quả của osimertinib.Dược học của thuốc Osimertinib 80mg
Thuốc Osimertinib liên kết không thể đảo ngược với các protein thụ thể biểu hiện yếu tố tăng trưởng biểu hiện bởi EGFR với đột biến T790M, nó cũng liên kết không thể đảo ngược với EGFR với một đột biến L858R và với một sự xoá bỏ exon 19.
Nó thể hiện dược động học tuyến tính; thời gian trung bình để Cmax là 6 giờ (khoảng 3-24 giờ). Thời gian bán hủy trung bình ước tính là 48 giờ, và độ thanh thải miệng (CL / F) là 14,2 (L / h). 68% thải trừ là phân và 14% bằng nước tiểu.Công thức hóa học của thuốc Osicent 80mg
Osimertinib được cung cấp như là mesylate; công thức hóa học là C28H33N7O2 • CH4O3S, và trọng lượng phân tử là 596 g / mol. Tên hoá học là N- (2- {2-dimetylaminoethyl-metylamino} -4-metoxy-5 - {[4 - (1-metylindol-3-yl) pyrimidin-2-YL] amino} phenyl) prop-2- enamide mesylate muối. [1]
Lịch sử ra đời của thuốc Osimertinib 80mg
Thuốc Osimertinib được nghiên cứu và công bố vào năm 2009 và thuốc được lưu hành vào năm 2012; quá trình được cấu trúc định hướng và nhằm mục đích tìm ra một chất ức chế EGFR thế hệ thứ ba mà có thể nhắm mục tiêu lựa chọn các hình thức T790M của thụ thể EGFR.
Osimertinib đã được chỉ định là một liệu pháp đột phá vào tháng 4 năm 2014 dựa trên các kết quả thử nghiệm Pha I, và thuốc đã được phê duyệt tạm thời theo chương trình phê duyệt tăng nhanh của FDA với một chứng từ xem xét ưu tiên vào tháng 11 năm 2015.
Vào tháng 2 năm 2016, EMA đã chấp thuận tạm thời osimertinib theo một quy trình tăng tốc - sự chấp thuận đầu tiên của chương trình.